關聯審評作為我國藥品審評審批制度改革的重要舉措,其落地實施正深刻重塑醫藥行業的管理生態。這一政策將原料藥、藥用輔料和藥包材與藥品制劑進行關聯審評,強調質量源于設計的理念,對醫藥企業的管理思維、組織架構和運營模式產生了系統性影響。
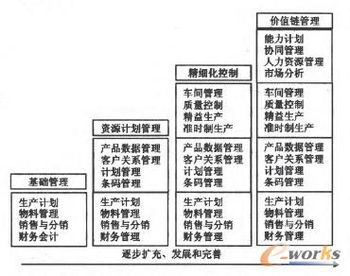
關聯審評強化了企業的全鏈條質量管理意識。傳統模式下,藥品生產企業往往將原料藥、輔料和包材視為獨立采購品,質量責任分散。關聯審評實施后,制劑企業需對上游供應商的質量體系承擔最終責任,這促使企業建立更嚴格的供應商審計機制,將質量管理延伸至產業鏈前端。企業必須重新評估與供應商的合作關系,從單純的價格競爭轉向質量與穩定供應的綜合考量。
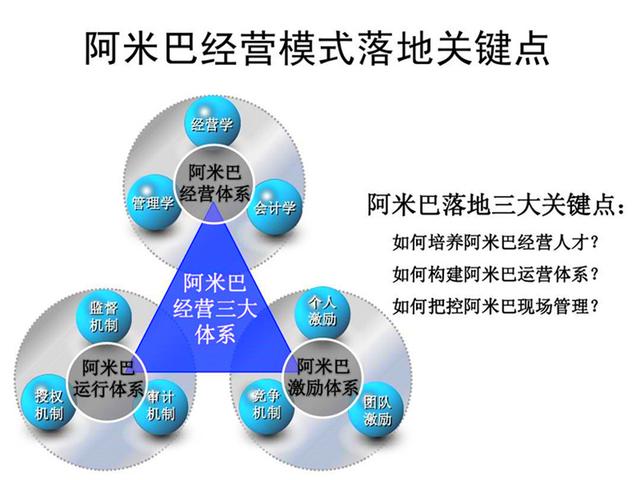
企業管理架構面臨重組壓力。為適應關聯審評要求,許多企業設立了專門的供應商管理部門,加強了質量部門與采購、研發部門的協同。跨部門協作成為常態,信息共享機制需要重新構建。同時,企業需投入更多資源用于供應商培訓和質量體系建設,管理成本短期內可能上升,但從長遠看,這種投入將轉化為產品質量優勢和市場競爭力的提升。
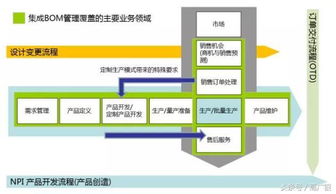
第三,研發管理策略發生重大轉變。關聯審評要求企業在藥品研發早期就充分考慮原料藥、輔料和包材的選擇,改變了以往先確定制劑工藝再尋找配套材料的做法。這要求研發部門與采購部門更緊密協作,建立材料質量與制劑性能的關聯數據庫,推動基于科學和風險的研發決策。
供應鏈管理面臨重構挑戰。關聯審評下,更換供應商需重新進行關聯審評,大大增加了供應商變更的成本和風險。這促使企業建立更穩定、更透明的供應鏈體系,減少對單一供應商的依賴,同時加強與核心供應商的戰略合作。數字化供應鏈管理系統成為企業管理升級的重要方向。
值得注意的是,關聯審評也加速了行業整合進程。規模較小、質量管理體系不完善的企業面臨更大壓力,而具備完善質量管理體系和強大供應商管理能力的企業將獲得競爭優勢。這種優勝劣汰效應將推動行業集中度提升,促進醫藥產業高質量發展。
關聯審評的深入實施將繼續推動醫藥企業管理創新。企業需要建立更加科學、透明、高效的管理體系,加強人才隊伍建設,提升風險管理能力,方能在政策變革中把握機遇,實現可持續發展。這一過程雖然帶來挑戰,但最終將促進我國醫藥行業整體管理水平的提升,為患者提供更安全、有效的藥品。